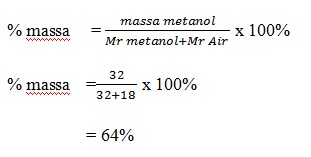kuis 3. Buatlah 2 soal (per chapter) pilihan ganda dari tugas kelompok lain (chapter 1 s/d 12 (selain chapter anda))
chapter 1
sifat kimia dapat membentuk zat baru dan tidak dapat kembali ke bentuk semula
chapter 2
3. Lambang suatu unsur ![]() dapat disimpulkan bahwa pada satu atom unsur X mempunyai. . .
dapat disimpulkan bahwa pada satu atom unsur X mempunyai. . .
A. 18 neutron dan 18 proton
B. 22 neutron dan 22 proton
C. 40 proton dan 18 elektron
D. 18 proton dan 22 neutron
E. 18 neutron, 22 proton, dan 22 elektron
Pembahasan :
Nomor atom suatu unsur menunjukkan banyaknya proton atau banyaknya elektron. Sedangkan banyaknya neutron adalah Nomor Massa dikurangi
Nomor Atomnya.
![]() berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
berarti unsur tersebut mempunyai 18 proton dan 18 elektron, dan (40 – 18) = 22 neutron.
Jawaban : D
4. Pada isotop unsur ![]() , jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
, jumlah proton dan netron kedua unsur secara berturut – turut adalah . . .
A. (26 , 26) : (88 , 88)
B. (26 , 26) : (88 , 138)
C. (26 , 30) : (88 , 138)
D. (26 , 30) : (88 , 266)
E. (26 , 56) : (88 , 138)
Pembahasan :
![]()
- X = lambang unsur
- Z = jumlah proton
- N = nomor atom
- M = massa atom
- Neutron = A – Z
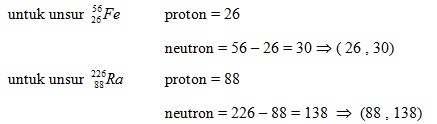
Jawaban : C
chapter 3
b. 94 x 10-23
massa rata-rata 1 atom Fe = Ar Fe x 112 x massa 1 atom 12C
massa rata-rata 1 atom Fe = 56 x 112 x 2 x 10-23
massa rata-rata 1 atom Fe = 9,3 x 10-23
Jadi massa rata-rata 10 atom Fe adalah :
massa assa rata-rata 10 atom Fe = 10 x 9,3 x 10-23 = 93 x 10-23
Hitunglah massa atom rata-rata (Ar) dari unsur Oksigen tersebut ?
Ar Oksigen =
Ar Oksigen = 16
chapter 5
chapter 6
9. Perubahan entalpi dari reaksi manakah yang berikut ini dapat disebut dengan perubahan entalpi pembentukan ΔHf° Na2SO4 kristal….
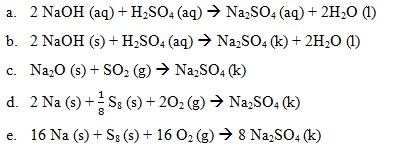
Pembahasan:
Perubahan entalpi pembentukan standar merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan stabil, pada 25°C dan tekanan 1 atm. Perubahan entalpi pembentukan standar suatu zat ditentukan dengan menggunakan rumus:
ΔHfo reaksi = ∑ ΔHf° hasil – ∑ΔHf° pereaksi
Reaksi pembentukan ΔHf° Na2SO4
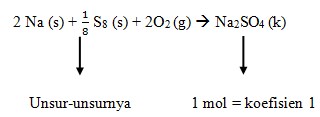
Jawaban : D
10.Jika diketahui ΔHc°C = -393,5 kJ mol‾¹ , berapa kalor yang terjadi pada pembakaran 1 kg arang, jika dianggap bahwa arang mengandung 48% karbon dan Ar C = 12?
a. 740 kJ
b. 470 kJ
c. 740 kJ
d. 470 kJ
e. 740 kJ
Pembahasan:
ΔHc°C = -393,5 kJ mol -1
massa C = 48/100 x 1000 gram
= 480 gram
Pada pembakaran 1 mol karbon dibebaskan kalor 393,5 kJ maka pada pembakaran 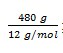 karbon dihasilkan kalor sebanyak:
karbon dihasilkan kalor sebanyak:
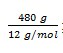 x 393,5 kJ/mol
x 393,5 kJ/mol
= 15.740 kJ
Jawaban : A
chapter 7
A. n = 3, l = 2, m = -1, s = +1/2
B. n = 3, l = 1, m = -1, s = +1/2
C. n = 3, l = 2, m = +1, s = +1/2
D. n = 3, l = 2, m = 0, s = +1/2
E. n = 3, l = 2, m = +2, s = +1/2
Pembahasan :
Dari orbital 3p kita dapatkan :
Harga n = 3
Harga l = 1 (karena sub kulitnya adalah p)
Jika l = 1, maka harga m yang mungkin adalah -1, 0, +1
Harga s yang mungkin hanya dua yaitu +1/2 dan -1/2
Jadi kemungkina nilai keempat bilangan kuantum suatu elektron yang menempati subkulit/ orbital 3p adalah :
n = 3, l = 1, m = -1, 0, +1 dan s = +1/2 atau -1/2
Jawaban : B
A. 1, 2, 3
B. 0, 1, 2, 3
C. 1, 2, 3, 4,
D. 0, 1, 2, 3, 4
E. Tidak bergantung pada harga n
Pembahasan :
Jika n = 4, maka :
Harga l = 0, .....(n-1) = 0, 1, 2, 3
chapter 8
a. Na, Cl, Mg, P
b. Cl, P, Mg, Na
c. Cl, P, Na, Mg
d. P, Cl, Na, Mg
e. Na, Mg, P, Cl
Pembahasan :
Urutan unsur periode ketiga dari kiri ke kanan : Na, Mg, Al, Si, P, S, Cl, Ar. Salah satu perubahan sifat unsur periode ketiga dari kiri ke kanan adalah makin mudah tereduksi, berarti sifat oksidator bertambah.
Sebaliknya, sifat reduktor (pereduksi) berkurang. Dengan demikian, untuk sifat pereduksi yang makin besar urutannya adalah : Cl, P, Mg, Na.
Jawaban : B
14.Unsur-unsur periode ketiga di alam terdapat dalam bentuk senyawa kecuali unsur belerang yang bebas, karena belerang…
a. Memiliki bentuk dua alotrop
b. Terletak pada perubahan sifat molekul raksasa menuju molekul sederhana
c. Mempunyai sifat afinitas elektron yang besar
d. Mempunyai nilai energi ionisasi yang kecil
e. Membentuk molekul sangat stabil
Pembahasan :
Unsur-unsur periode ketiga di alam terdapat dalam bentuk senyawa kecuali belerang sebab belerang membentuk molekul S8 yang stabil dan banyak terdapat di daerah gunung berani.
Jawaban : E
chapter 9
15. Perbedaan antara ion Na+dengan atom natrium adalah:
a. Ion Na+ kelebihan 1 proton
b. Ion Na+ kelebihan 1 elektron
c. Ion Na+ kekurangan 1 elektron
d. Ion Na+ kekurangan 1 proton
e. Ion Na+ kekurangan 1 neutron
Jawaban: C
Pembahasan:
Ion Na+ memiliki ion positif maka kekurangan satu elektronnya, dari yang 11 nomor atomnya menjadi 10 disebabkan melepaskan 1 elektron. Ion Na+ ini melepaskan 1 elektron untuk mencapai kestabilannya. beda dengan Na yang nomor atomnya 11. Dilihat dari konfigurasi elektronnya:
Na+ : 2 8
Na : 2 8 1
Dilihat ev nya makanya, Na+ kekurangan elektronnya.
16. Diketahui nomor atom unsur:
A= 3 D= 12
B= 4 E= 9
C= 11 F= 17
Ikatan paling ionic dapat terbentuk antara ….
a. A dengan E
b. A dengan F
c. C dengan E
d. C dengan F
e. B dengan F
Jawaban: C
Pembahasan:
Konfigurasi electron pada soal ini yaitu:
3A= 2 1 12D= 2 8 2
4B= 2 2 9E= 2 7
11C= 2 8 1 17F= 2 8 7
Pada konfigurasi yang ikatan ionic paling kuat yaitu yang bisa mencapai kestabilan sesuai dengan kaidah octet, yang menurut G. N. Lewis dan W. Kossel, kestabilan unsur gas mulia disebabkan oleh electron valensinya yang berjumah delapan, keculi He yang hanya memiliki dua electron.
Sehingga didapatkan jawabannya yaitu C dengan F, yang unsur C melepas satu electron sedangkan yang unsur F menerima satu electron agar stabil.
chapter 10
17. Bentuk molekul bipiramida trigonal memiliki orbital hibrida
A. sp
B. sp²
C. sp³
D. sp³d
E. sp³d²
Jawaban : D
Pembahasan :
Yang benar adalah : sp³d
Contoh : bipiramida trigonal adalah PCl5
Membuktikannya, pertama konfigurasikan dengan asas aufbau unsur pusat yaitu P yg hanya terdiri 1 saja. P nomor atomnya 15
P : 1s², 2s², 2p6, 3s², 3p³
Ambil bagian terakhir mulai dari s
Berarti -> 3s² dan 3p³
18. Jika nomor atom S = 16 dan nomor atom F = 9, maka bentuk molekul SF4 adalah …
A. Segitiga datar
B. Bentuk V
C. Tetrahedral
D. Tetrahedral terdistorsi
E. Linear
Jawaban : C
Pembahasan :
Diketahui :
S = 2 8 6
F = 2 7
Dit : Type SF4 ?
Jawab
SF4 memiliki :
PEI = 4
PEB = 1
Jadi type molekulnya
AX4E1 (Tetrahedral)
Jawaban : C
chapter 11
19. Zat tunggal yang tidak dapat diuraikan lagi menjadi zat lain dengan reaksi kimia biasa disebut ….
a. senyawa
b. unsur
c. campuran
d. larutan
Jawaban : B
Pembahasan :
Unsur kimia adalah suatu spesies atom yang memiliki jumlah proton yang sama dalam inti atomnya (yaitu, nomor atom, atau Z, yang sama).
20. Berikut ini adalah nama-nama unsur, kecuali ….
a. oksigen
b. nitrogen
c. udara
d. besi
Jawaban : C
Pembahasan
Udara bukan merupakan unsur, karena di udara terdapat banyak unsur-unsur kimia penyusunnya.
chapter 12
21. Larutan fruktosa dengan konsentrasi 1,476 M mempunyai massa jenis 1,2 g/ml. Berapa kemolala larutan adalah …. (Mr fruktosa = 180)
a. 1,75 mol/kg
b. 1,87 mol/kg
c. 1,77 mol/kg
d. 1,85 mol/kg
e. 1,90 mol/kg
Jawaban : C
Pembahasan
Basis perhitungan 1 L larutan fruktosa
Kemolalan laerutan fruktosa, m = n fruktosa / w air x 1.000
Diketahui, dalam 1 L larutan
– mol fruktosa, n Fruktosa = 1,476 mol
– menghitung massa air, w air = w larutan –w froktosa
Massa larutan
= ρ x V
= 1,1 g/Ml x 1000 ml
= 1100 g
Massa fruktosa = n fruktosa x Mm
= 1,476 mol x 180 g/mol
= 265,6 g
Diperoleh w air = w larutan – w fruktosa = 1100 g – 265,6 g = 834,4 g
Jadi, kemolalan larutan fruktosa
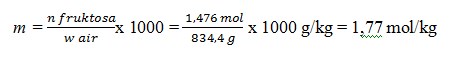
22. Fraksi mol larutan methanol CH3OH dalam air adalah 0,50. Kosentrasi methanol dalam arutanini dinyataan dalam persen berat methanol adalah …. Ar C = 12, O = 16, H =1
a. 64 %
b. 54%
c. 63%
d. 62%
e. 60%
Jawaban : A
Pembahasan :