Kuis 8. Buatlah 2 soal (per chapter) pilihan ganda dari tugas kelompok lain Chapter 13 s/d 18).
chapter 13
1. Kedalam ruang yang volumenya 2 liter, dimasukkan 4 mol gas HI yang kemudian terurai menjadi gas H2 dan I2.
Setelah 5 detik, dalam ruang tersebut terdapat 1 mol gas H2. Tentukan laju reaksi pembentukan gas H2 dan laju reaksi peruraian gas HI berturut-turut adalah …
a. 0,1 M/detik dan 0,2 M/detik
b. 0,2 M/detik dan 0,1 M/detik
c. 0,1 M/detik dan 0,5 M/detik
d. 0,5 M/detik dan 0,1 M/detik
e. 0,2 M/detik dan 0,2 M/detik
Jawaban : A
Pembahasan :
Persamaan reaksi : 2 HI(g) → H2(g) + I2(g)
Mula-mula : 4 mol – –
Setelah 5 detik : 2 mol 1 mol 1 mol

2.Suatu reaksi kimia yang berlangsung pada suhu 30°C memerlukan waktu 40 detik. Setiap kenaikan suhu 10°C, reaksi akan lebih cepat dua kali dari semula. berapakah waktu yang diperlukan jika suhu dinaikkan menjadi 50°C…
a. 30 detik
b. 20 detik
c. 15 detik
d. 10 detik
e. 5 detik
Jawaban : D
Pembahasan :
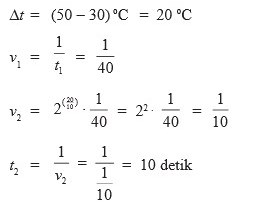
chapter 14
1. Rumusan tetapan kesetimbangan untuk reaksi :

Pembahasan :
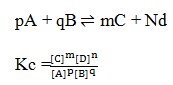
Hukum kesetimbangan yaitu bila suatu reaksi dalam keadaan setimbang, mak hasil kali konsentrasi zat-zat hasil reaksi dipangkatkan koefisiennya dibagi dengan hasil kali konsentrasi zat-zat pereaksi dipangkatkan koefisiennya akan mempunyai harga tetap. Jika reaksi itu dalam wujud solid dan liquid maka diabaikan.
Jawaban : E
2. Gas A,B, dan C masing-masing 0,4 mol, 0,6 ,mol, dan 0,2 mol dicampurkan dalam ruang tertutup dan terjadi reaksi kesetimbangan:
![]()
Pada saat setimbang 0,3 mol gas A telah bereaksi, maka gas B yang ada dalam keadaan setimbang adalah…
a. 0,5 mol
b. 0,4 mol
c. 0,3 mol
d. 0,2 mol
e. 0,1 mol
Pembahasan :
Dengan menggunakan perbandingan koefisien maka :
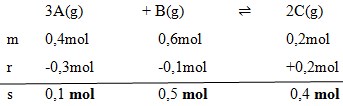
Jawaban : A
chapter 16
1. Larutan jenuh basa L(OH)3 mempunyai pH = 10. Nilai Ksp basa itu adalah . . . .
a. 3,3 x 10-17
b. 4 x 10-16
c. 2,7 x 10-15
d. 4 x 10-12
e. 3,3 x 10-5
(Michael Purba, 2006, Kimia untuk SMA Kelas XI, Jakarta : Erlangga. Hal. 277. No. 6)
Jawaban : C
Pembahasan:
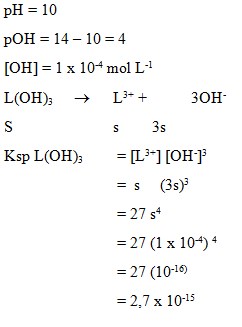
2. Rumus hasil kali kelarutan (KSP) Ag2CrO4 dinyatakan sebagai…
a. [Ag] [CrO4]
b. [Ag+] [CrO4-2]
c. [Ag+]2 [CrO4-2]
d. [Ag+] [CrO–]4
e. [Ag4+]2 [CrO2]4
(Kimia Untuk SMA Kelas XI, Unggul Sudarmo, Phibeta, 2006, h 219)
Pembahasan:
![]()
Jawaban : C
chapter 17
1. Perubahan entalpi dari reaksi manakah yang berikut ini dapat disebut dengan perubahan entalpi pembentukan ΔHf° Na2SO4 kristal….
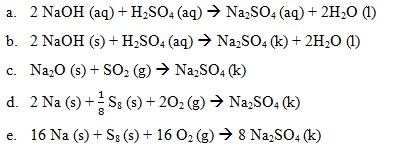
Pembahasan:
Perubahan entalpi pembentukan standar merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan stabil, pada 25°C dan tekanan 1 atm. Perubahan entalpi pembentukan standar suatu zat ditentukan dengan menggunakan rumus:
ΔHfo reaksi = ∑ ΔHf° hasil – ∑ΔHf° pereaksi
Reaksi pembentukan ΔHf° Na2SO4
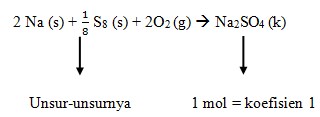
Jawaban : D
2, Diantara persamaan termokimia di bawah ini yang merupakan perubahan entalpi penguraian adalah…
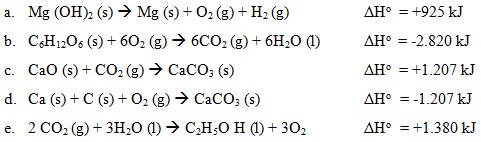
Pembahasan:
Perubahan entalpi penguraian standar adalah perubahan entalpi yang terjadi pada penguraian 1 mol suatu senyawa menjadi unsur-unsurnya yang paling stabil pada keadaan standar.
Pada dasarnya, perubahan entalpi penguraian standar merupakan kebalikan dari perubahan entalpi pembentukan standar, maka nilainya pun akan berlawanan tandanya. Jadi dari pilihan ganda yang di atas, jawaban yang tepat adalah A karena reaktannya berupa satu mol menjadi unsur-unsurnya.
Jawaban: A
chapter 18
1. Logam yang dapat mencegah korosi pada bumper mobil adalah …
a. Kromium
b. Timbal
c. Timah
d. Magnesium
e. Nikel
Jawaban : A
Pembahasan :
Untuk mencegah korosi pada bumper mobil, bumper mobil tersebut dilapisi oleh kromium.
Kromium dapat melindungi bumper mobil dari korosi. Kromium juga memberi kesan yang mengkilap pada bumper mobil. Proses pelapisan ini dinamakan Cromium Plating (pelapisan dengan kromium.
2. Pada elektrolisis leburan Al2O3 ( Ar O = 16, Al = 27 ) diperoleh 0,225 gram Al. Jumlah Arus Listrik yang diperlukan adalah …
a. 221,9 Coulomb
b. 804,0 Coulomb
c. 025,9 Coulomb
d. 412,5 Coulomb
e. 685,0 Coulomb
Jawaban : D
Pembahasan :
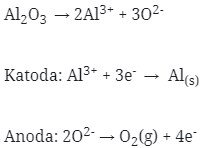
Mol Al = gram / ar = 0.225 / 27 = 0,00833 mol
Mol e = 12 / 4 x mol Al = 3 x 0,00833 = 0,025 mol e = 0.025 F
Q = 0,025 x 96.500 = 2.412,5 Coulomb


